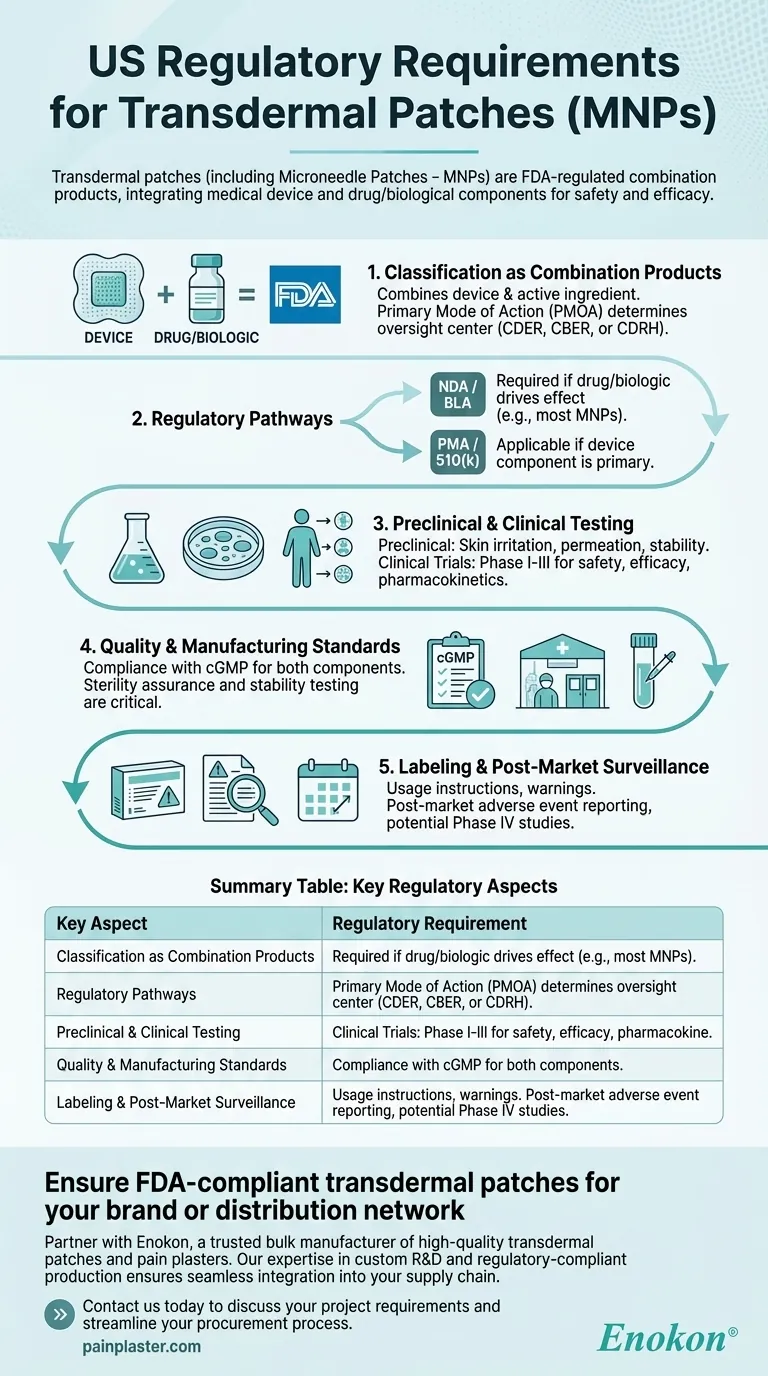
Трансдермальные пластыри, в том числе пластыри с микроиглами (ПМП), регулируются в США FDA как комбинированные продукты, требующие строгих процессов утверждения для обеспечения безопасности и эффективности. Эти продукты включают в себя медицинское устройство и лекарственный/биологический компонент, что требует соблюдения особых правил регулирования в зависимости от их основного способа действия. Процесс утверждения включает доклинические и клинические испытания, контроль качества, соблюдение стандартов маркировки и производства.
Разъяснение ключевых моментов:
-
Классификация комбинированных препаратов
- FDA относит к категории трансдермальные пластыри к комбинированным продуктам, поскольку они сочетают в себе медицинское устройство (например, основу пластыря, микроиглы) и лекарственный или биологический активный ингредиент.
- Основной способ действия (PMOA) определяет, регулируется ли продукт Центром по оценке и исследованию лекарственных средств (CDER), Центром по оценке и исследованию биологических препаратов (CBER) или Центром по устройствам и радиологическому здоровью (CDRH).
-
Пути регулирования
- Заявка на новое лекарство (NDA) или заявка на получение биологической лицензии (BLA): Требуется, если препарат или биологический компонент обеспечивает терапевтический эффект.
- Предварительное разрешение на продажу (PMA) или 510(k): Применяется, если компонент устройства является первичным (например, микроиглы, способствующие доставке лекарств).
- МНП часто проходят путь NDA/BLA из-за их лекарственно-ориентированной функции.
-
Доклинические и клинические испытания
- Доклинические исследования: Включают в себя испытания на раздражение кожи, проницаемость и стабильность для оценки безопасности и эффективности доставки.
- Клинические испытания: Испытания I-III фаз оценивают фармакокинетику, эффективность и побочные эффекты на людях.
-
Стандарты качества и производства
- Соблюдение действующей надлежащей производственной практики (cGMP) как для лекарственных препаратов, так и для компонентов устройств.
- Обеспечение стерильности и тестирование стабильности являются критически важными для патчей с биологическими препаратами.
-
Маркировка и постмаркетинговое наблюдение
- Этикетки должны содержать инструкции по применению, предупреждения и условия хранения.
- Постмаркетинговые требования включают отчетность о неблагоприятных событиях и возможные исследования IV фазы.
Для покупателей понимание этих требований обеспечивает согласование с поставщиками, соответствующими требованиям FDA, и снижает риски несоответствия продукции. Задумывались ли вы о том, как эти требования влияют на сроки закупок или критерии выбора поставщиков? Взаимодействие надзора за устройствами и лекарственными препаратами спокойно определяет надежность современной трансдермальной терапии.
Сводная таблица:
| Ключевой аспект | Нормативное требование |
|---|---|
| Классификация | Регулируются FDA как комбинированные продукты (устройство + лекарство/биологический препарат). |
| Основной способ действия | Определяет надзор со стороны CDER (лекарство), CBER (биологическое средство) или CDRH (устройство). |
| Пути утверждения | NDA/BLA (на основе лекарственных препаратов) или PMA/510(k) (на основе устройств). МНП обычно следуют за NDA/BLA. |
| Требования к испытаниям | Доклинические (безопасность, проницаемость) и клинические испытания (фазы I-III). |
| Производственные стандарты | Соответствие требованиям cGMP для компонентов лекарств и устройств; обеспечение стерильности для биопрепаратов. |
| Постмаркетинговые обязательства | Отчеты о неблагоприятных событиях, исследования IV фазы и соответствие маркировке. |
Обеспечьте соответствие трансдермальных пластырей требованиям FDA для вашего бренда или дистрибьюторской сети.
Сотрудничайте с
Энокон
надежным производителем высококачественных трансдермальных пластырей и обезболивающих пластырей. Наш опыт в области индивидуальных исследований и разработок и производства, отвечающего нормативным требованиям, обеспечивает беспрепятственную интеграцию в вашу цепочку поставок.
Свяжитесь с нами сегодня
чтобы обсудить требования вашего проекта и оптимизировать процесс закупок.
Визуальное руководство
Связанные товары
- Трансдермальные пластыри с дальним инфракрасным теплом для облегчения боли
- Согревающие пластыри для облегчения боли при менструальных спазмах
- Пластырь Heat Relief Capsicum для облегчения боли в пояснице
- Лекарственные пластыри для снятия боли с капсаицином чили
- Медицинские охлаждающие гелевые пластыри от лихорадки Охлаждающие пластыри
Люди также спрашивают
- Как пластыри Deep Heat Pain Relief обеспечивают облегчение боли?Целенаправленная тепловая терапия для длительного комфорта
- Как работает пластырь для спины Deep Heat Pain Relief?Безлекарственное снятие боли с помощью терапевтического тепла
- Как действует капсаицин в лечебном тепловом пластыре?Наука, лежащая в основе облегчения боли
- Можно ли использовать тепловые пластыри при свежих травмах?Почему холодная терапия работает лучше
- Каковы общие побочные эффекты использования лекарственного теплового пластыря?Понимание рисков и безопасное использование
















